Il modello atomico
Gli atomi sono i componenti più piccoli della materia; a loro volta sono composti di particelle subatomiche disposte secondo ben precise regole.
La materia è composta da particelle minuscole invisibili al microscopio, gli atomi. La certezza della loro esistenza deriva da studi e osservazioni approfonditi del comportamento della materia. Attraverso plurimi esperimenti si è anche dimostrata la presenza di particelle elettricamente cariche all’interno dei singoli atomi, che prendono il nome di particelle subatomiche; queste conferiscono agli atomi le proprietà che caratterizzano gli elementi chimici radunati nella tavola periodica.
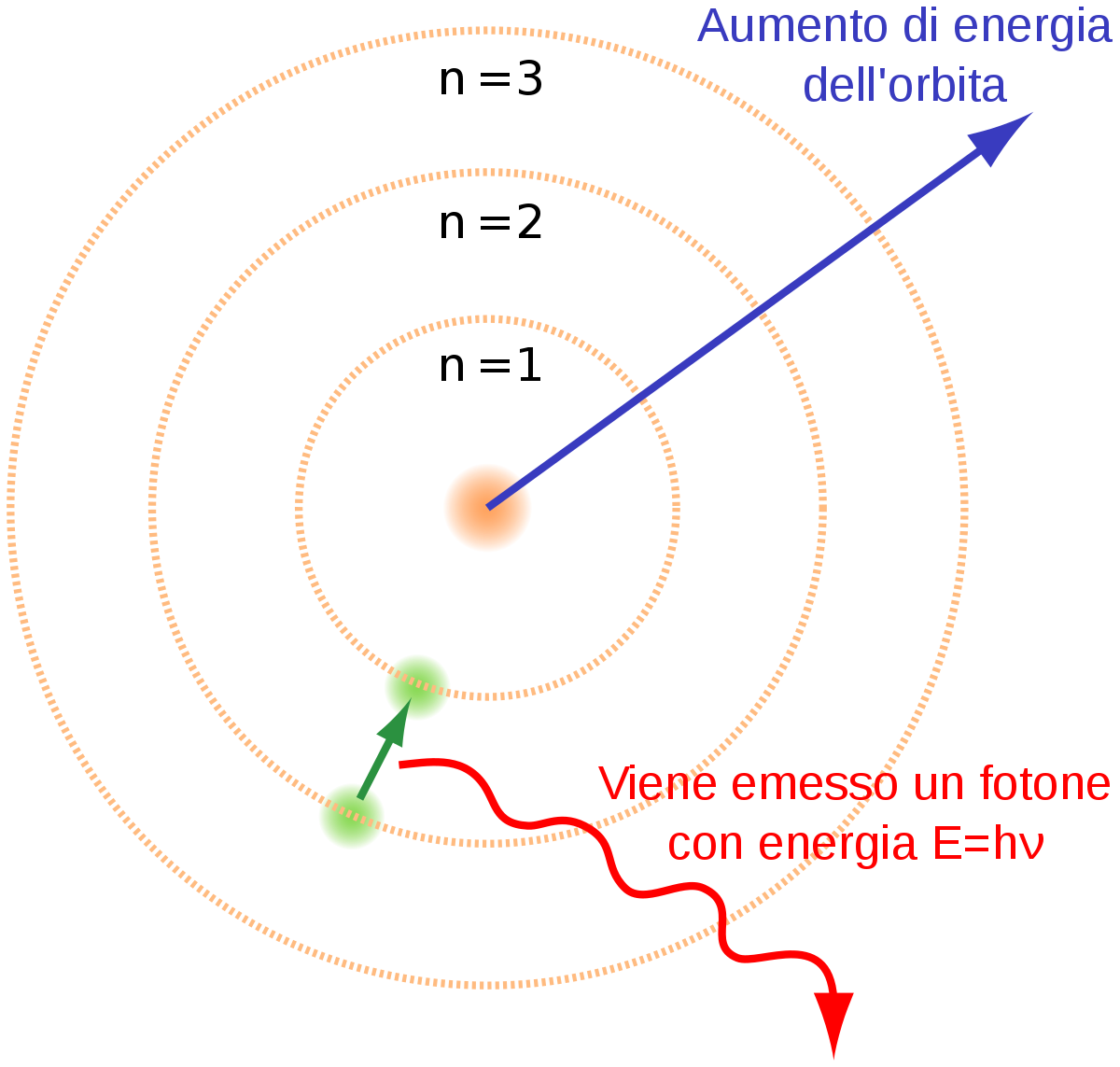
Il modello atomico nucleocentrico è facilmente assimilabile al modello eliocentrico del sistema solare. Infatti gli elettroni possono essere paragonati ai pianeti che ruotano attorno al sole, e così come questi ultimi, anche gli elettroni seguono precise orbite che non permettono loro di scontrarsi: tali traiettorie sono chiamate funzioni d’onda orbitaliche e sono caratterizzate secondo tre numeri quantici, che ne descrivono l’energia, la forma e l’orientazione nello spazio. Secondo il principio di Pauli ogni orbitale può contenere fino a un massimo di due elettroni, che non si scontrano tra loro né collassano sul nucleo.
Com’è possibile?
Il nucleo carico positivamente attrae gli elettroni, carichi negativamente. Questi a loro volta ruotano attorno al proprio asse esercitando una forza contraria che fa sicché non collassino sul nucleo, così come i pianeti non collassano sul sole. Ancora, i due elettroni che si trovano nello stesso orbitale non si scontrano, nonostante percorrano la stessa traiettoria, perché i versi di rotazione attorno al proprio asse sono contrari. Tale proprietà è descritta dal quarto numero quantico, detto numero quantico di spin, che può assumere solo due valori l’uno l’opposto dell’altro – +1/2; -1/2 -.
La principale caratteristica che un atomo deve rispettare è l’elettroneutralitá: il numero di cariche positive e negative all’interno di un atomo deve essere uguale in modo che queste si annullino a vicenda. Questa peculiarità non esclude però la possibilità che gli atomi interagiscano tra loro dando vita a reazioni di formazione o deterioramento di prodotti.
Marta Maresca




